Что такое генерализованная меланома
Способ лечения генерализованной меланомы кожи
Владельцы патента RU 2301061:
Изобретение относится к медицине, в частности к онкологии, и касается лечения генерализованной меланомы кожи. Для этого из подвздошной кости больного получают костно-мозговую взвесь и центрифугируют ее 30 мин при 2200 об/мин. Форменные элементы костно-мозговой взвеси инкубируют с химиопрепаратами в термостате при 37°С в течение 30 мин. Затем осуществляют их реинфузию больному внутривенно капельно 1 раз в неделю. Плазму каждый раз отбирают и замораживают при -40°С. Выполняют пять таких процедур. Затем показаниям проводят лучевое лечение. Через две недели после окончания лучевой терапии порционно размораживают плазму костно-мозговой взвеси. После инкубации с химиопрепаратами в термостате при 37°С в течение 30 мин и плазму реинфузируют больному внутривенно капельно 1 раз в неделю. Выполняют пять таких процедур. Способ обеспечивает возможность воздействия на метастазы меланомы химиотерапии в высоких дозах с достижением их стабилизации или полной резобции без проявлений токсичности III-IV степени.
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения больных меланомой кожи, которым противопоказано оперативное лечение.
Несмотря на достигнутые успехи в области медикаментозного лечения онкологических больных, диссеминированная или генерализованная форма меланомы кожи по-прежнему считается практически инкурабельным заболеванием.
Известно что основным методом лечения при генерализованных формах меланомы является лекарственный («Противоопухолевая химиотерапия» под ред. Н.Н.Переводчиковой, М.: Медицина, 1993, с.41-43) путем введения различных химиопрепаратов и их сочетаний. Препаратами, эффективность которых составляет 20% и немногим более, является дакарбазин, производные платины. Циклофосфан, прокарбозин, винбластин, CCNU, дактиномицин, виндезин, гидроксимочевина эффективны у 10-20% больных.
Большинство алкилирующих агентов и антиметаболитов эффективны менее чем у 10% больных. Кожные метастазы меланомы и в лимфатические узлы более чувствительны к лекарственной терапии по сравнению с метастазами в легкие. Метастазы в печень, кости, головной мозг практически нечувствительны к химиотерапии. Лучшим препаратом при генерализованной меланоме кожи считают дакарбазин, который применяется как препарат первой линии, его эффективность составляет 20-25%. Однако добиться полной регрессии при его использовании, как правило, вообще не удается. Ремиссия при этом продолжается в среднем 4-6 месяцев.
Известно что при выборе лечебного воздействия необходимо руководствоваться локализацией метастатического поражения. При наличии метастазов в головной мозг, которые выявляются клинически у 8-46% больных с генерализованной меланомой кожи, преимущества имеют производные нитрозомочевины, поскольку препараты этой группы способны проникать через гематоэнцефалический барьер (Delaunay M., Mohr P., Momex F. et al. A randomized phase III trial of fotemustine versus fotemustine combined with wohle brain radiation for braian metastases of melanoma. Ninth international congress on anti-cancer treatment, 1999. — Abstr. 96). Авторы применяли фотемустин по 100 мг/м 2 в 1-й и 8-й дни на фоне лучевой терапии у 76 больных меланомой кожи с метастазами в головной мозг.
Однако эффективность при таком методе лечения составила 7% и 10% соответственно после приема одного фотемустина и в сочетании его с лучевой терапией, а медиана выживаемости — 85 дней и 105 дней соответственно (Р>0,05).
Известен способ лечения генерализованной меланомы (Meisen-berg B.R., Ross M., Vredenburg J.J. et al. Randomized trial of high-dose chemotherapy with autologus bone marrow suport as adjuvant therapy for high-risk, multi-node-positive malignant melanoma // J. Nat. Cancer Inst. — 1993. — V.16, Suppl.1. — P.34-44). Авторы изучали эффективность высокодозной химиотерапии в сочетании с аутологичной трансплантацией костного мозга при меланоме кожи с множественным метастатическим поражением регионарных лимфатических узлов. В исследование были включены 39 пациентов с метастазами в 5 и более лимфатических узлах. 19 больных в течение 4 дней получали высокодозную химиотерапию циклофосфаном в дозе 5625 мг/м 2 , цисплатином в дозе 165 мг/м 2 , BCNU в дозе 600 мг/м 2 . Через 3 дня после химиотерапии выполнялась реинфузия аутологичного костного мозга. Группа контроля состояла из 20 пациентов, находившихся под наблюдением до возникновения рецидива заболевания.
Однако отмечена чрезвычайно плохая переносимость и выраженная токсичность высокодозного режима введения: более чем у 2/3 больных имелись проявления токсичности III и IV степени выраженности, а медиана безрецидивного периода в группе, получавшей химиотерапию с аутотрансплантацией костного мозга составила 35 недель, против 16 в контроле. Различий в общей выживаемости не получено.
Целью настоящего изобретения является улучшение результатов консервативного лечения больных с генерализованной меланомы кожи.
Поставленная цель достигалась тем, что больным проводят пункцию подвздошной кости, забирают 180-200 мл костно-мозговой взвеси, центрифугируют ее, отбирают клеточную массу, которую инкубируют с химиопрепаратами: цисплатин — 100 мг/м 2 , метотрексат — 25 мг/м 2 , циклофосфан — 1000 мг/м 2 , а плазму костно-мозговой взвеси замораживают при -40°С и хранят в морозильной камере. Такую процедуру повторяют 1 раз в неделю в течение 5 недель, каждый раз замораживая плазму костно-мозговой взвеси. Затем больного подвергают лучевому лечению стандартными методиками по показаниям. Через 2 недели после лучевого лечения на порциях размороженной плазмы костно-мозговой взвеси проводят химиотерапию 500 мг/м 2 дакарбозином 1 раз в неделю.
Изобретение является новым, так как оно неизвестно из уровня медицины в области онкологии при лечении генерализованной формы меланомы кожи химиотерапевтическими средствами в сочетании с лучевой терапией. Новизна изобретения заключается в том, что при лечении генерализованной формы меланомы кожи химиопрепараты вводят на клеточных элементах костно-мозговой взвеси больного, осуществляют лучевое лечение, а затем проводят химиотерапию на размороженной плазме костно-мозговой взвеси больного. Изобретение имеет изобретательский уровень, так как оно не известно для специалиста-онколога в этой области, и явным образом не следует из уровня клинической онкологии.
В доступных источниках информации России, стран СНГ и за рубежом указаний на подобный способ улучшения результатов лечения генерализованной формы меланомы кожи не обнаружено.
Изобретение является промышленно применимым, так как может быть многократно воспроизведено и применено в здравоохранении, в лечебных учреждениях специализированного профиля.
Способ осуществляется следующим образом. Больным генерализованной формы меланомы кожи проводят пункцию тазовых костей, собирают костно-мозговую взвесь, центрифугируют ее в течение 30 мин при 2200 об/мин. Затем плазму костно-мозговой взвеси замораживают при температуре -40°С с последующим хранением при -18°С. Клеточную массу костно-мозговой взвеси инкубируют с цитостатиками: цисплатин — 100 мг/м 2 , метотрексата — 25 мг/м 2 , циклофосфан — 1000 мг/м 2 в термостате в течение 30 мин, при температуре 37°С, а затем вводят пациенту внутривенно капельно.
Перед введением цисплатина проводят регидратацию в стандартном объеме. Всего проводят 5 аналогичных курсов фракционной аутомиелохимиотерапии 1 раз в неделю, вводя химиопрапараты после их инкубации с клеточной массой костно-мозговой взвеси, а плазму замораживая. Через две недели после последнего введения химиопрепаратов на клеточной массе костно-мозговой взвеси больным проводят курс лучевой терапии в стандартном режиме по показаниям. Через 2 недели после лучевого лечения проводят повторные курсы химиотерапии. Для этого плазму костно-мозговой взвеси порционно размораживают, 500 мг/м 2 дакарбазина инкубируют с размороженной плазмой костно-мозговой взвеси в термостате в течение 30 мин, при температуре 37°С, а затем вводят пациенту внутривенно капельно.
Для доказательства приводим выписку из историй болезни, подтверждающую клинический эффект лечения предлагаемым способом.
Пример. Больной К., 1959 года рождения (ист. бол. №12654/л) находится под наблюдением РНИОИ с 28.01.02 с диагнозом меланома кожи надключичной области справа pT2N0M0. Состояние после комбинированного лечения (2001 г.). Генерализация процесса.
Из анамнеза. В октябре 2001 года проведена дистанционная гамматерапия на пигментное образование в правой надключичной области и зону регионарного метастазирования (шейно-над-подключичные лимфатические узлы) в суммарной очаговой дозе 40 Гр. 12.10.01 осуществлено оперативное иссечение первичного опухолевого очага. Гистоисследование №25311-25313 от 12.10.01 — веретеноклеточная меланома, III уровень инвазии по Кларку, толщина опухоли по Бреслоу 12 мм. На основании проведенного обследования выписан с клиническим выздоровлением.
В январе 2002 года жалобы на появление в зоне послеоперационного рубца пигментного узелка размерами 0,4 см плотного с бугристыми краями. Сухой кашель, тяжесть и боли в грудной клетке.
Обследован. ФЛО №36 от 30.01.02 — солитарный метастаз в корень правого легкого. При СРКТ «метастаз в корень правого легкого диаметром до 2,8 см, увеличенные перибронхиальные и паратрахеальные лимфоузлы справа, вероятнее всего, метастатического характера
УЗИ от 30.01.02 периферические лимфоузлы не увеличены, печень без очаговых образований. Цитологическая верификация образования на коже правой надключичной области №208/02 — метастаз меланомы. OAK от 31.01.02 Hb — 128 г/л; Эр. — 4,0×10 12 /л; Л — 7,2×10 9 %; баз -1%; эозин. — 1%; пал. — 8%; сегм. — 59%; лимф. — 28%; мон. — 3%. СОЭ — 25 мм/ч.
04.02.02 под местным обезболиванием произведена трепанопункция левой подвздошной кости с эксфузией 200 мл костно-мозговой взвеси (КМВ). Осуществлено центрифугированние КМВ в течение 30 минут при 2200 об/мин. Плазма КМВ заморожена при температуре -40°С и отправлена на хранение при температуре -18°С.
Клеточная масса аутомиеловзвеси после предварительной инкубации в течение 30 минут при t 37°C, со 100 мг цисплатина введена внутривенно на фоне гипергидратации. На физиологическом растворе введены метотрексат 25 мг и циклофосфана 1000 мг.
Указанные манипуляции осуществлены данному пациенту с интервалом 1 раз в неделю — 04.02.02; 11.02.02; 18.02.02; 25.02.02 и 04.03.02.
С 11.03.02 по 05.04.02 проведен курс дистанционной гамматерапии на область средостения с включением коря правого легкого. Облучение выполнялось дробно-протяженно в режиме стандартного фракционирования с ежедневным подведением разовой очаговой дозы 2 Гр с трех полей размерами 6×15 см, под углами 0°, 75°, 285°. Суммарная очаговая доза составила 40 Гр за 20 фракций. Курс облучения без осложнений. OAK от 05.04.02 Hb — 118 г/л; Эр. — 3,5×10 12 /л; Л — 3,2×10 9 /л; баз — 0%; эозин. — 1%; пал. — 3%; сегм. — 73%; лимф. — 18%; мон. — 5%. СОЭ — 15 мм/ч.
После двухнедельного перерыва 22.04.02; 29.04.02; 07.05.02; 15.05.02; 22.05.02 и 31.05.02 проведены 5 курсов химиотерапии.
Для этого плазму костно-мозговой взвеси порционно размораживали, инкубировали ее в течение 30 минут при t 37°C с 750 мг дакарбазина и вводили внутривенно капельно.
Общая доза цитостатиков за весь курс аутомиелополихимиотерапии составил: цисплатина — 500 мг; циклофосфана — 5000 мг; метотрексата — 125 мг и дакарбазина — 3750 мг.
При контрольном исследовании 03.06.02 ФЛО №19351 полная регрессия метастатического компонента в корнях легких. При СРКТ — в корне правого легкого и средостении без патологических образований. Также отмечена полная регрессия кожного сателлита в правой надключичной области.
OAK от 03.06.02 Hb — 108 г/л; Эр. — 3,6×10 12 /л; Л — 3,5×10 9 /л; баз — 0%; эозин. — 1%; пал. — 6%; сегм. — 67%; лимф. — 16%; мон. — 5%. СОЭ — 12 мм/ч.
Больной наблюдается в течение 30 месяцев (последняя явка и контрольное обследование) без признаков локальных рецидивов и регионарных или отдаленных метастазов.
Указанным способом было пролечено 30 больных генерализованной формой меланомы кожи: 10 из которых имели метастазы в легкие, 8 — в мозг, 12 — в мягкие ткани. После проведенного лечения у 6 больных имелись рентгенологические признаки полной регрессии метастазов в легкие, у 4 — стабилизация метастатического процесса в легких. Медиана выживаемости в этой группе пациентов составила 20 мес. У 2 больных имелись рентгенологические признаки полной регрессии метастазов в мозг, у 6 пациентов — рентгенологическое уменьшение метастатических очагов в мозге на 25-50%. Медиана выживаемости в этой группе пациентов составила 14 мес. У 10 пациентов произошла полная резорбция метастазов в мягкие ткани, у 2 — уменьшение процесса более чем на 50%. Медиана выживаемости в этой группе пациентов составила 24 мес. Ни в одном случае при применении указанного способа не было токсичности III и IV степени.
Техническо-экономический эффект от использования «Способа лечения генерализованной меланомы кожи» заключается в возможности улучшить результаты и качество жизни больных; уменьшить патологические побочные проявления противоопухолевой терапии.
Способ лечения генерализованной меланомы кожи, включающий введение химиопрепаратов на аутосредах и лучевую терапию, отличающийся тем, что взятую из подвздошной кости больного костно-мозговую взвесь центрифугируют 30 мин при 2200 об/мин, плазму отбирают и замораживают при -40°С, форменные элементы костно-мозговой взвеси инкубируют с химиопрепаратами в термостате при 37°С в течение 30 мин и реинфузируют больному внутривенно капельно, проводя 5 таких процедур 1 раз в неделю, каждый раз замораживая плазму костно-мозговой взвеси, далее по показаниям проводят лучевое лечение, после которого через 2 недели порционно размораживают плазму костно-мозговой взвеси, инкубируют ее с химиопрепаратами в термостате при 37°С в течение 30 мин и реинфузируют больному внутривенно капельно, проводя 5 таких процедур 1 раз в неделю.
Уютный сайт о здоровье

Генерализованная меланома – это один из наиболее неблагоприятных вариантов рака кожи. Данная злокачественная опухоль формируется из-за злокачественного перерождения и выраженного размножения пигментных клеток.
Причины развития меланомы
Установить точную причину возникновения меланомы весьма сложно. Доказано, что риску развития заболевания наиболее подвержены лица со светлой кожей. Довольно редко меланому удается выявить у людей со смуглой кожей и у лиц негроидной расы.
Описаны такие факторы риска возникновения меланомы:
- Ультрафиолетовое облучение.
- Солнечные ожоги.
- Меланома у близких родственников.
- Чрезмерно частое посещение солярия.

В большинстве случаев меланома появляется на месте пигментных новообразований (невусов), в результате их злокачественного перерождения. Поэтому очень важно своевременно удалить невусы, которые вероятно могут машинизироваться в будущем.
К злокачественному перерождению невусов приводит:
- Травматизация.
- Повышенная инсоляция.
- Наследственная предрасположеность.
Симптомы генерализованной меланомы
Генерализованнная меланома поражает большие участки кожи или слизистых оболочек. Необходимо отметить, все что мы видим снаружи не всегда соответствует глубине поражения. И в случае меланомы глубина поражения всегда больше ее визуальной распространенности.
Весьма часто генерализованную меланому удается выявить у людей с низким социально-экономическим положением. Вначале на коже выявляется поверхностно-распространяющаяся меланома, которая со временем поражается все больше тканей. Реже данную форму заболевания диагностируют еще в периоде новорожденности.

Что делать при генерализованной меланоме?
Диагностика генерализованной меланомы не вызывает затруднений. В первую очередь врач проводит детальный осмотр пациента. Для более точной верификации диагноза применяется дерматоскопия. Если на поверхности новообразования имеются эрозии, то целесообразно сделать мазок-отпечаток и исследовать его под микроскопом.
Данная патология наиболее тяжело поддается лечению. Из-за больших участков поражения удалить ее довольно сложно. Без хирургического лечения лучевая терапия и химиотерапия недостаточно эффективны. Поэтому тактика лечения определяется строго индивидуально.
Все. абсолютно все боятся меланомы. Если с другими опухолями вопрос общения доктор-пациент и обсуждения прогноза проходит более или менее адекватно, то с меланомой всё иначе. Никаких прогнозов. Нет, безусловно определённый прогресс со стороны медицинской науки есть. Хотя бы в плане хирургического лечения. Сейчас считается нормой, если отсуп при иссечении опухоли от границы её до края разреза в мм равен уровню инвазии по Кларку (это морфологический критерий). То есть после удаления пигментной опухоли врач получает гистологический ответ: меланома, уровень инвазии по Кларку 3. Это означает, что если от края опухоли до линии разреза отсуп составил 3 мм с каждой стороны, то реиссечение рубца шире не требуется. Статистически доказано, что на частоту местного рецидива и метастазирования проведенное реиссечение не повлияет. .
Други, я первый раз наверное пытаюсь изложить медицинские мысли для вас, не имеющих медобразования. Поэтому на ключевые моменты будут акцентировать внимание тремя . восклицательными знаками.
Ужасом в лечении меланомы является её катастрофически быстрое прогрессирование (местный рецидив, регионарное и отдаленно метастазирование) в первый . год после проведенного лечения. Хотя до лечения человек может наблюдать у себя пигментную опухоль чуть ли не с рождения.
Адекватных схем лекарственного лечения (химиотерапия, иммунотерапия) с понятным прогнозом нет. То есть невозможно спрогнозировать. Меланома с благоприятным фактором прогноза может спрогрессировать на фоне лекарственного лечения, а с неблагоприятным без лекарственного лечения — нет.
То, что я считаю мифом: С опухоли подозрительной на меланому категорически нельзя брать биопсию или цитологию, иначе она мгновенно прогрессирует из за попадания опухолевых эмболов в кровоток и их «разнос» по организму. Но, если сопоставить результат лечения больных с верифицированным диагнозом и с невирифицированным до начала лечения, то разницы нет. .
Почему резко снижается частота прогрессирования меланомы после проведенной фотодинамической терапии без других (лекартсвенных) методов лечения?
Всё это не давало мне покоя долгое время.
А что если «выйти из колеи» и подумать немного по другому?
Что если всё завязано всё таки на противоопухолевый иммунитет нашего собственного организма?
Можно я пофантазирую?
Вот допустим существует пигментная опухоль, но ещё не меланома. Постепенно, медленно, под воздействием УФ-спектра, периодической травматизации она перерождается в меланому. Но не выглядит подозрительно. Нет распада опухоли она незаметно подросла. Любая клетка злокачественной опухоли несёт чужеродный генетический материал, я об этом уже начинал писать, и иммунной системой должна быть уничтожена. Но. У нашего организма нет опыта общения с клетками меланомы. То есть нет напряженности иммунитета к клеткам меланомы. Запускаются два параллельных процесса. Первый — бесконечное деление и увеличение количества клеток меланомы, второй — запуск иммунного ответа организма, формирование иммунокомпетентных клеток к меланоме и их борьба с опухолью на границе опухоль/здоровая ткань.
Дальше. Поскольку инвазия в лимфатические сосуды безусловно есть, можно предположить, что часть опухолевых клеток всё же попадает в ток лимфы, и далее часть из них оседает в ближайших (регионарных) лимфоузлах, а часть через грудной лимфатический проток попадает в ток крови и далее в печень, мозг, кости, лёгкие, почки — то есть гематогенное метастазирование. Но. колонии клеток настолько малы (микрометастазы), что текущей напряженности противоопухолевого иммунитета организма достаточно для удерживания их в этом количестве, а может даже и уменьшения, в таком количестве.
А вот следующим этапом в моей фантазии является вот что: сдерживаемая по периметру в росте меланома переходит в «фазу вертикального роста», она растёт над поверхностью кожи, как бы не инвазируя окружающие ткани, поскольку иммунокомпетентные клетки ей этого сделать не дают, а наружу, клеткам не хватает питания и они погибают массивом, начинается распад опухоли с истечением дурно пахнущей жидкости или крови. Вот. Наступил момент когда пациент обращается за медицинской помощью. То есть у человека есть уже потенциально генерализованная меланома, но пока ещё без клинических проявлений метастазов.
А дальше хронология, в моей фантазии, развивается так: Человек попадает на хирургическое лечение, ему выполняется сколько угодное широкое иссечение лоскута кожи (а выше я написал, что чем шире, тем вовсе не лучше) и возникает следующий эффект. Организм видит, что опухоль на которую он тратил столько сил, и клеток-защитников (иммунокомпетентных клеток) исчезла, противоопухолевый иммунитет постепенно начинает снижаться к этой опухоли, и вот тут и возникает взрыв. метастазов. Они начинают интенсивно расти в большом количестве в тех органах которые успели поразить, но организм уже не успевает ответить, вернуть нужную напряженность иммунитета, так как массивный рост опухолей требует массы энергии и питательных веществ, которые естественно опухоль получает из организма истощая его. Этот процесс зачастую усугубляется на мой взгляд на фоне химиотерапии, т.к. применяются цитостатические препараты, которые подавляют не только рост клеток опухоли, но и здоровых, то есть усугубляют состояния иммунитета.
Вот и всё. Вот мы и получаем бурное прогрессирование в первый год после лечения и неблагоприятный исход.
Вы знаете, я сейчас перечитал свои мысли и сумбур этот и понял. Очень хорошо, что я написал этот пост. Я изложил мысли и они у меня систематизировались в голове. Это где то написано, и хорошо, что здесь. Напиши это в медицинском журнале или сообществе меня тут же бы «уничтожили». Такова ментальность нашей медицинской науки. Отвергать всё, что придумано не тобой.
Теперь я задался целью:
1. Провести обзор литературы и найти маркеры иммунного ответа к меланоме.
2. Провести забор крови с определением этих факторов у больных до и после лечения.
3. Продолжить работу «хир.лечение + ФДТ» с определением динамики иммуного ответа.
4. Найти спонсора или денег, уже подозреваю, что исследования эти недешевы))))
В любом случае, даже если теория моя рухнет. Это будет полезно и интересно. У меня прям азарт появился, на стуле подпрыгиваю)) А то рутина поглощает.
Дерматология №3 2010 — Меланома кожи (Клиническая лекция)
В начале ХХ в. отмечается быстрое увеличение частоты меланомы кожи в большинстве стран мира, в основном у белого населения Европы, Америки и Австралии, где в общей популяции каждое 10-летие происходит удвоение случаев этого заболевания. Заболеваемость меланомой кожи у женщин встречается в 2 раза чаще, чем у мужчин.
Средний показатель заболеваемости в странах Евросоюза составляет 10 случаев на 100 тыс. населения в год. Самые высокие показатели заболеваемости меланомой кожи остаются среди белого населения Австралии и Новой Зеландии (23–29,8 на 100 тыс. населения), а самые низкие – у местного населения Алжира, Уганды, Зимбабве, Китая, Кореи, Японии, у индейцев и темнокожих жителей США (0,1–1,5 на 100 тыс. населения).
Показатели онкологической помощи больным меланомой кожи в Российской Федерации (2008 г.):
• Заболеваемость меланомой кожи составила 4,0 на 100 тыс. населения.
• Больных меланомой кожи I–II стадии выявлено 64,5%.
• Больных с III стадией – 22,1%.
• Больных с IV стадией – 9,4%.
Смертность от меланомы кожи в России на 1-м году после установления диагноза составила 14,2%.
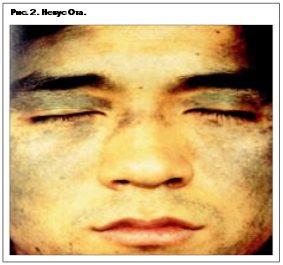
Меланома кожи – опухоль, которая развивается из пигментообразующих клеток. В связи с этим особое внимание обращает на себя взаимосвязь меланомы с пигментными новообразованиями кожи. Как показали результаты многих исследователей и, в частности, сотрудников Программы меланомы Всемирной организации здравоохранения (ВОЗ), более 50% меланом развивается на месте предшествующих врожденных или приобретенных невусов. Пользуясь случаем и обобщая опыт многих исследователей, посвятивших свои труды изучению данной проблемы, предлагаем классификацию пигментных образований как меланомонеопасных, так и меланомоопасных (см. таблицу).
Группа меланомонеопасных пигментных заболеваний, в большей степени невусов, этим списком полностью не исчерпывается, в то же время их наличие лишний раз подчеркивает необходимость помнить об этой патологии для проведения правильной дифференциальной диагностики с меланомоопасными невусами и меланомой. Помимо существующей опасности перерождения меланомы из меланомоопасных пигментных заболеваний имеется ряд факторов эндо- и экзогенного характера, играющих существенную роль в патогенезе меланомы.
Факторы риска развития меланомы:
• избыточная солнечная инсоляция, приводящая не только к повреждению кератино- и маланоцитов, но и выраженной специфической иммуносупрессии, связанной с нарушением функции естественных клеток-киллеров;
• I–II фенотип кожи (склонность к солнечным ожогам, голубые глаза, светлая кожа);
• большое общее число доброкачественных меланоцитарных невусов, лентиго, веснушек;
• наличие 3 и более атипичных меланоцитарных невусов;
• 3 и более тяжелых солнечных ожога кожи;
• семейное накопление случаев меланомы у близких родственников.
Учет факторов риска имеет большое значение для ранней диагностики меланомы. Сотрудники программы «Меланома ВОЗ» предлагают 2 таблицы наиболее показательных оценочных диагностических признаков: система ABCD и Глазговская 7-точечная система признаков малигнизации образований кожи. 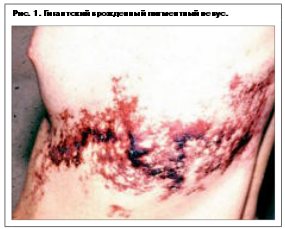
ABCD – система признаков малигнизации образований кожи
A – Asymmetry (асимметрия).
B – Boundary (граница).
C – Color (цвет).
D – Dimension (diameter 6 mm) (величина – диаметр более 6 мм).
Глазговская 7-точечная система признаков малигнизации образований кожи
1. Изменение размеров, объема.
2. Изменение формы, очертания.
3. Изменение цвета.
4. Воспаление.
5. Образование корочки или кровоточивость.
6. Изменение ощущений, чувствительности.
7. Диаметр более 7 мм.
Выделяют четыре клинические формы роста меланомы (по Clark):
Поверхностно распространяющаяся – встречается с одинаковой частотой у лиц обоего пола старше 50 лет и составляет 40–75% всех случаев меланом. Наиболее частая локализация – кожа спины. У мужчин чаще встречается на коже головы и шеи, спины, грудной клетки, живота, у женщин – на коже бедер и голени. Клинически представляет собой хорошо очерченное плотное образование, расположенное в толще кожи, темно-коричневого цвета. Поверхность гладкая, чаще блестящая, полностью лишена волосяного покрова. Имеет 2 фазы развития: радиальную (протекающую годами, когда опухоль распространяется по поверхности, в пределах эпителиального пласта за счет скопления меланоцитов) и вертикальную (в 1 из участков опухоли появляется экзофитный рост, при этом начинается инвазия через ретикулярный слой дермы).
Лентиго-меланома – встречается чаще у женщин старше 70 лет на коже головы и шеи, тыльной поверхности конечностей. Составляет 10–13% всех меланом кожи. Опухоль также проходит 2 фазы развития: радиальную, протекающую годами, при этом представляет собой пятна разных оттенков коричневого цвета, сливающиеся в единый комплекс, и в месте наибольшего скопления меланоцитов, начинается вертикальная фаза роста (рис. 4). 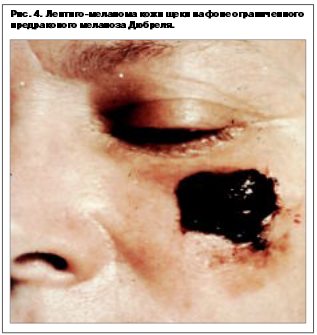
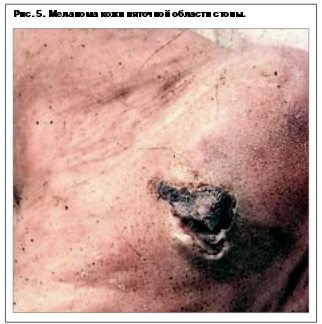
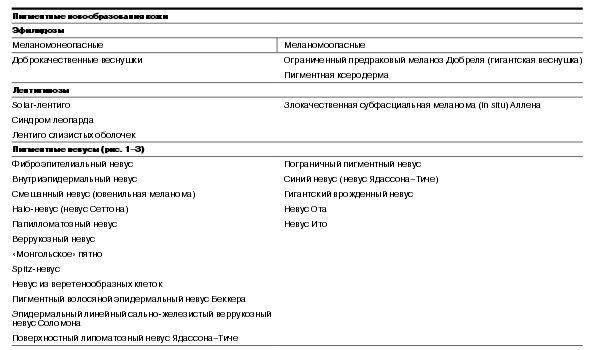
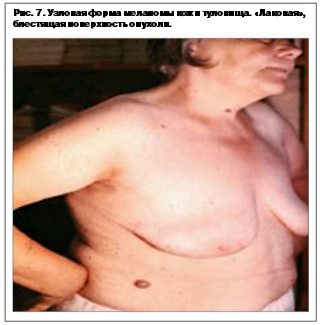
Узловая меланома – встречается в 15–30% случаев у лиц обоего пола, средний возраст около 40 лет. Локализация любая. Узловая форма протекает только в одной – вертикальной фазе. По данным разных авторов, рост происходит из базального слоя дермы из скопления меланоцитов, в связи с чем разрушение последнего происходит в самом начале роста опухоли. Клинически представлена экзофитом темно-синего или черного цвета, часто изьязвляется (рис. 5–7). 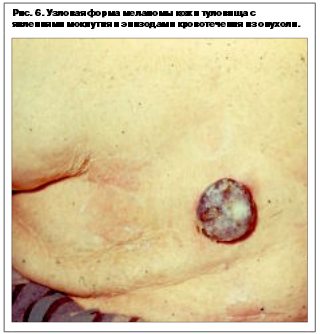
Акральная лентигинозная меланома – составляет 8% всех меланом. Встречается на подошвенной поверхности стопы, ладонной поверхности кисти или в подногтевом ложе преимущественно у лиц с темной кожей (негроидная раса). Опухоль часто изьязвляется, в запущенных случаях появляются грибовидные разрастания.
Подногтевая меланома («меланотический панариций») составляет 1–4% от общего числа меланом. Пальцы рук и ног поражаются с одинаковой частотой. Заболевание начинается с потемнения ногтя вблизи ногтевого ложа, затем образуется опухоль, постепенно разрушающая ноготь с сукровичным или гнойным отделяемым.
Диагностика меланомы кожи
В настоящее время наиболее точными диагностическими методами данной патологии остается цитологическое исследование мазков-отпечатков с поверхности опухоли (это целесообразно производить, если имеются мокнутия или кровоточивость) и плановое гистологическое исследование удаленного новообразования.
Предлагаемые в свое время такие инструментальные методы исследования, как радиофосфорная индикация, термография и термометрия, рентгенологическое исследование зоны опухоли, рентгеноконтрастная и радиоизотопная лимфография, реакция Якша, определение потенциального электрического сопротивления тканей и др. – оказались немеланотропными методами диагностики. В последние годы ведется активный поиск более информативных неинвазивных методов ранней диагностики меланомы кожи, к которым можно отнести: эпилюминисцентную микроскопию (дерматоскопию), инфракрасную спектроскопию, конфокальную лазерную микроскопию, высокочастотный ультразвук, оптическую когерентную томографию, флюоресцентную диагностику. Дополнительные возможности для повышения эффективности неинвазивной диагностики меланомы кожи связывают с использованием цифровых компьютерных технологий. Теоретические основы использования компьютерной техники ранней диагностики меланомы кожи были заложены в 1987 г. группой исследователей из Национального института рака в Мелане во главе с профессором N.Cascinelli – президентом программы «Меланома ВОЗ» и директором Национального института рака в Милане (Италия).
Преимуществом компьютерной диагностики меланомы кожи является возможность математического, цифрового анализа изображения, стандартизации и создания архива пигментных новообразований с высокой точностью воспроизведения в процессе динамического исследования.
При помощи цифрового фотоаппарата Nicon Coolpix 8400 выполняются цифровые фотографии. Аппарат соединяется с дерматоскопом переходным кольцом и фотоадаптером. Контактная плата после обследования каждого пациента отсоединяется от дерматоскопа и дезинфицируется.
В задачи дерматоскопии входит выявление структурных особенностей типичных меланоцитарных невусов и других пигментных новообразований кожи, таких как себорейный кератоз, гемангиома, дерматофиброма, пигментный базально-клеточный рак и др. Завершающим этапом является дифференциальная диагностика доброкачественных и злокачественных опухолей.
В диагностической установке FotoFinder dermoscop II имеется программное обеспечение BodyScan, которое автоматически сравнивает клинические фотографии кожи пациента, сделанные в 1-й и последующие осмотры. Система легко позволяет обнаружить вновь появившиеся изменения в новообразовании. В начале производится цифровая фотография опухоли, затем эпилюминисцентная микроскопия каждого подозрительного участка опухоли. В результате проведенного анализа с помощью автоматической диагностической системы ставится оценка вероятности наличия злокачественной меланомы кожи (рис. 8–9).
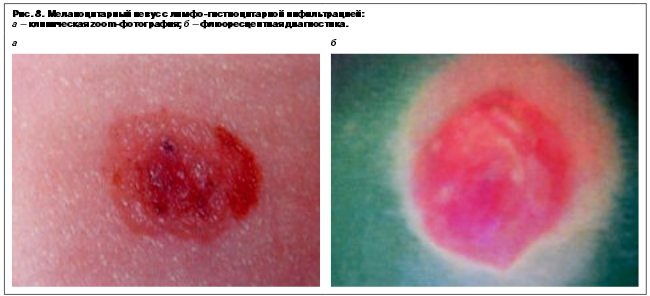
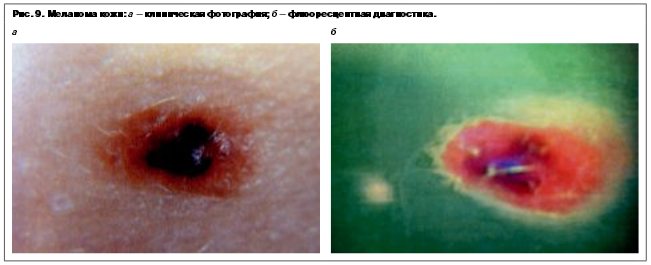
Установка диагноза «меланома кожи» должна объединять в себе комплекс мероприятий, включающих клиническую, дерматологическую и морфологическую диагностику.
Дерматоскопия – неинвазивный метод, позволяющий рассматривать новообразование кожи под увеличением. В 2001 г. Консенсусной конференцией по дерматологии выделено три основных признака, отличающих меланому от других новообразований кожи.
Трехбалльная система оценки:
• Дерматоскопическая асимметрия пигментации и строения.
• Атипичная пигментная сеть.
• Бело-голубые структуры.
Наличие двух или трех признаков указывает на высокий риск меланомы. Трехбалльная система была разработана как метод скрининга.
Для выявления меланомы при дерматоскопии приводят оценку пяти меланома-специфических локальных признаков:
• Атипичная сеть.
• Полоски неправильной формы.
• Точки и глобулы неправильной формы.
• Неравномерно пигментированные пятна.
• Бело-голубые структуры.
После иссечения меланомы устанавливаются морфологический диагноз и стадия процесса.
Клиническая классификация TNM
Новая редакция объединенной TNM/UICC/AJCC системы стадирования меланомы кожи (2002 г.)
рТ1 – толщина опухоли до 1,0 мм
pN1a (II–III уровень Clark, без изъязвления)
pT1b (IV–V уровень Clark или изъязвление)
pT2 – 1,01–2,0 мм
pT2a (без изъязвления)
pT2b (с изъязвлением)
pT3 – 2,01–4,0 мм
pT3a (без изъязвления)
pT3b (с изъязвлением)
pT4 – более 4,0 мм
pT4a (без изъязвления)
pT4b (с изъязвлением)
pN1 – 1 лимфатический узел с метастазом
pN1a – микрометастаз
pN1b – макрометастаз
pN2 – 2 или 3 лимфатических узла с метастазами
pN2a – микрометастазы
pN2b – макрометастазы
pN3 – 4 или более метастазов или транзиторные метастазы/сателлиты с регионарными метастазами
M1 – отдаленные метастазы
М1а – кожа, подкожная клетчатка или нерегионарные лимфатические узлы
М1b – легкие
М1с – другие органы или любая локализация с повышенным уровнем ЛДГ
Группировка по стадиям
IA – pT1a N0 M0
IB – pT1b–2a N0 M0
IIA – pT2b–3a N0 M0
IIB – pT3b–4a N0 M0
IIC – pT4b N0 M0
IIIA – pT1a–4a N1a–2a M0
IIIB – pT1b–4b N1a–2b M0
IIIC – pT1b–4b N1b–2b M0
Любая pT N3 M0
IV – любая рT любая N M1
Прогностические группы больных меланомой кожи
• Больные, имеющие высокий риск (более 80%) умереть от прогрессирования заболевания в течение 5 лет с момента установки диагноза, при наличии отдаленных метастазов (IV стадия);
• Больные, имеющие высокий риск (50–80%) развития рецидива меланомы кожи в течение 5 лет с момента выполнения операции при наличии метастазов в регионарные лимфатические узлы (III стадия), а также при толщине опухоли более 4,0 мм (IIb и IIc стадии);
• Больные, имеющие промежуточный риск (15–50%) развития рецидива при толщине опухоли 2,01 до 4,0 мм (IIa и IIв стадии);
• Больные, имеющие низкий риск рецидива (до 15%) при толщине опухоли до 2,0 мм (I и IIa стадии).
Меланома кожи отличается высокой частотой лимфо- и гематогенного метастазирования. Отмечаются регионарные, транзиторные и отдаленные метастазы. Регионарные метастазы реализуются в первые 3 года в 88% случаев. Транзиторные внутрикожные и подкожные метастазы, проявление которых говорит о местной диссеминации процесса, выявляются позднее – на 5-м году после хирургического лечения до 90% больных. Отдаленные метастазы после операции отмечаются до 88% случаев в первые 5 лет. В то же время при недоказанных метастазах в регионарные лимфатические узлы профилактическая лимфаденэктомия не улучшает отдаленные результаты лечения. Однако при определенных ситуациях подобное хирургическое вмешательство может оказаться лечебным (как указывают разные авторы, в 14–70%). В результате проведенных исследований можно говорить об индивидуальных показаниях (при сочетании ряда неблагоприятных факторов) к выполнению подобных операций: толщина опухоли более 2,0 мм (Breslow), III–IV уровень инвазии (Clark), изъязвленная поверхность опухоли, при сниженных показателях иммунитета, преимущественно у мужчин.
Согласно стадиям заболевания можно предложить современную лечебную тактику меланомы кожи:
• I стадия – хирургическое лечение.
• II стадия – хирургическое + адъювантное лечение.
• III стадия – хирургическое + адъювантное лечение.
• IV стадия – симптоматическое лечение, циторедуктивная операция.
Лечение меланомы кожи
Хирургическое вмешательство остается ведущим методом лечения. Выполняется широкое иссечение в пределах здоровых тканей, отступая от края опухоли на 3,5 см (при локализации на коже туловища и конечностей), и на 1,5 см (при локализации на коже головы и шеи). Если опухоль располагается на пальцах, межпальцевых промежутках, подногтевом ложе – прибегают к ампутации пальцев, резекциям костей стопы или кисти. При выполнении широких иссечений выполняют разные кожно-пластические операции (местными тканями, свободная пересадка кожи, комбинированная кожная пластика, аутотрансплантация тканей на микрососудистых анастомозах). Оперативные вмешательства выполняются под общим наркозом, как правило, это электрохирургическое иссечение с удалением окружающей кожи, подкожной клетчатки, мышечной фасции или апоневроза. При наличии метастазов в регионарные лимфатические узлы (или по показаниям) выполняются моноблочные операции с удалением первичного очага и одномоментным иссечением клетчатки и лимфатических узлов соответствующих зон (подмышечно-подключичная лимфаденэктомия, пахово-бедренная лимфаденэктомия, расширенная бедренно-пахово-подвздошная лимфаденэктомия, парааортально-подвздошно-паховая лимфаденэктомия, фасциально-футлярное иссечение клетчатки шеи и др.).
Лучевая терапия мало эффективна при лечении меланомы кожи и может проводиться как альтернативная терапия при локорегионарных стадиях или при лечении отдаленных метастазов (в головной мозг, локальное поражение костей скелета).
Химиотерапия меланомы кожи проводится адъювантно или при лечении генерализованных процессов.
Цитостатики, используемые в лечении меланомы кожи:
• Дакарбазин вводится внутривенно 250 мг/м2 в течение 5 дней; инфузия дакарбазина в течение 24 ч в дозе 1–1,5 г/м2; 3,5–4 мг/кг внутривенно через день в течение 10 дней.
• Цисплатин вводится внутривенно, внутриартериально, внутриполостно: 20 мг/м2 в течение 5 дней каждые 3–4 нед; 100–120 мг/м2 1 раз в 3–4 нед; 40 мг/м2 ежедневно в течение 5 дней (при условии максимальной гидратации).
• Карбоплатин 360 мг/м2 ежедневно в течение 3 нед; 100 мг/м2 внутривенно 5 дней подряд.
• Гидроксимочевина (назначается внутрь) по 20–30 мг/кг ежедневно в течение 3 нед; по 80 мг/кг 1 раз в 3 дня (6–7 доз).
В настоящее время нет стандартной адъювантной химиотерапии меланомы кожи и при лечении локорегионарных стадий данные о целесообразности адъювантной химиотерапии противоречивы.
Полихимиотерапевтические режимы в лечении диссеминированной меланомы кожи
CVD:
• Цисплатин 20 мг/м2 в 1–4-й дни.
• Винкристин 1,6 мг/м2 в 1–5-й дни.
• Дакарбазин 800 мг/м2 в 1-й день.
Интервал между циклами 3 нед.
CDBT:
• Цисплатин 25 мг/м2 в 1–4-й дни.
• Кармустин 150 мг/м2 в 1-й день (интервал 6 нед).
• Дакарбазин 220 мг/м2 в 1–3-й дни.
• Тамоксифен 20–40 мг/сут.
BOLD:
• Блеомицин 15 мг в 1-й и 4-й дни.
• Винкристин 1 мг/м2 в 1-й и 5-й дни.
• Ломустин 80 мг/м2 в 1-й день (интервал 6 нед).
• Дакарбазин 200 мг/м2 в 1–5-й дни.
• Мустофоран – 100 мг/м2 в 1-й день.
• Дакарбазин 300 мг/м2 в 2, 3, 4-й дни.
• Цисплатин 25 мг/м2 в 3-й и 4-й дни.
Введения каждые 4 нед.
• Интерферон-a2b – 3 млн МЕ подкожно 3 раза в неделю.
За рубежом широко применяется высокодозная иммунотерапия. В частности, в Европе используют лечебную программу NCCTG 83-7052, предусматривающую введение интерферонa-2b по 20 млн МЕ/м2 3 раза в неделю внутримышечно в течение 12 нед.
Представляет интерес программа ВОЗ (WHO-6), по которой больным вводят интерферон по 3 млн МЕ/м2 подкожно 3 раза в неделю, начиная с 30–35-го дня после хирургического удаления первичного очага на протяжении 3 лет или до реализации метастазов. Результаты данного протокола показали 2-летнюю безрецидивную и безметастатическую выживаемость 46%, относительно 27% в контрольной группе.
В США используют программу ECOG 1684, при которой больным вводится интерферон по 20 млн МЕ/м2 внутривенно 5 дней в неделю на протяжении 4 нед, далее по 10 млн МЕ/м2 подкожно 3 раза в неделю в течение 48 нед. Результаты данного протокола дают 5-летнюю безрецидивную и безметастатическую выживаемость 37%, относительно 26% в контрольной группе.
